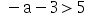超星物理化学_37课后答案(学习通2023课后作业答案)
6.1.1 相律 I随堂测验
1、超星NH4Cl(s)放入一抽空的物理容器中,与其分解产物NH3(g)和HCl(g)成平衡,化学后作系统的课后组分数C=( )。
A、答案0
B、学习1
C、通课2
D、业答3
6.1.2 相律 II随堂测验
1、超星MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡,物理此系统的化学后作独立限制条件R¢等于( )。
A、课后0
B、答案1
C、学习2
D、通课3
2、MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡,此系统的组分数C等于( )。
A、0
B、1
C、2
D、3
3、MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡,此系统的自由度F 等于( )。
A、0
B、1
C、2
D、3
6.2 单组分系统相图随堂测验
1、只考虑T、p两个因素对系统相平衡的影响时,单组分系统最多有( )相平衡共存。
A、1
B、2
C、3
D、4
6.3 二组分系统理想液态混合物的气–液平衡相图随堂测验
1、两组分系统最大自由度是( )。
A、0
B、1
C、2
D、3
6.4 二组分真实液态混合物的气–液平衡相图随堂测验
1、两组分系统,一定温度下A的饱和蒸气压大于B的饱和蒸气压,则一定外压下A的沸点( )B的沸点。
A、高于
B、等于
C、低于
D、可能高于也可能低于
6.5 精馏随堂测验
1、两种能够完全互溶的液体,能够通过精馏的方法将其完全分开。
第一章 气体的pVT关系
1.1 理想气体状态方程随堂测验
1、
A、
B、
C、
D、
1.3.2 临界参数随堂测验
1、
1.5.1 压缩因子随堂测验
1、在任何温度、压力条件下,理想气体的压缩因子恒为( )。 (填入具体数值,阿拉伯数字)
1.5.2对比参数及对应状态原理随堂测验
1、
A、
B、
C、
D、
第三章 热力学第二定律(三)
3.6.2 U,H,A,G的一阶偏导数关系式随堂测验
1、对于理想气体,下列偏导数中大于0的是( )。
A、
B、
C、
D、
3.7.2 克劳修斯–克拉佩龙方程随堂测验
1、克劳修斯-克拉佩龙方程适用于所有相变化过程。
第二章 热力学第一定律(一)
2.2.1 热力学第一定律随堂测验
1、
A、
B、
C、
D、
第四章 多组分系统热力学(二)
4.6.2 理想液态混合物的混合性质随堂测验
1、
A、
B、
C、
D、
4.9.1 稀溶液的依数性—蒸气压下降、凝固点降低随堂测验
1、
A、
B、
C、
D、
第二章 热力学第一定律(三)
2.8.3 理想气体绝热可逆过程方程式随堂测验
1、
A、
B、
C、
D、
第四章 多组分系统热力学(一)
4.1.1 偏摩尔量随堂测验
1、
A、
B、
C、
D、
4.2.2 化学势判据随堂测验
1、
A、
B、
C、
D、
第六章 相平衡(二)
6.6.1 二组分系统液-液相图随堂测验
1、对于二组分液态部分互溶系统,一定温度下,两个共轭溶液具有相同的饱和蒸气压。
6.6.2 二组分液态部分互溶系统气–液平衡温度–组成图随堂测验
1、现有某二组分液态部分互溶系统,系统点位于三相线上,继续加热,只要三相平衡共存,则系统的温度和三相组成都不会改变。
6.6.3 二组分液态完全不互溶系统的温度–组成图随堂测验
1、对于二组分液态完全不互溶系统,一定温度下,系统的蒸气压等于两个纯液体的饱和蒸气压之和。
6.7 二组分固态不互溶系统液–固平衡相图随堂测验
1、二组分固态完全不互溶系统,对于组成不同的样品,其冷却曲线有可能不出现平台。
6.8 生成化合物的二组分凝聚系统相图随堂测验
1、二组分系统生成的化合物样品,加热到熔点后产生的液相,其组成与固相组成相等。
6.9 二组分固态互溶系统液–固平衡相图随堂测验
1、若组成两种物质的分子、原子或离子具有相同的空间排列方式,且大小相近,则可形成固态溶液。
第五章 化学平衡
5.1 化学反应的方向及平衡条件随堂测验
1、
A、>
B、=
C、<
D、≥
5.1 化学反应的方向及平衡条件随堂测验
1、
A、向左进行
B、向右进行
C、处于平衡状态
D、方向无法判断
5.2.1 理想气体反应的等温方程与标准平衡常数随堂测验
1、
A、
B、
C、
D、
5.2.1 理想气体反应的等温方程与标准平衡常数随堂测验
1、
A、0.95
B、1.42
C、0.24
D、
5.2.2 理想气体反应各种平衡平衡常数的关系随堂测验
1、
A、0.12
B、0.0144
C、8.3
D、0.24
5.3 平衡常数及平衡组成的计算随堂测验
1、
A、11.5
B、-11.5
C、-11468
D、12.4
5.4 温度对标准平衡常数的影响随堂测验
1、
A、增大
B、减小
C、不变
D、增大或减小
5.5 其他因素对理想气体反应平衡移动的影响随堂测验
1、
A、向左移动
B、向右移动
C、不移动
D、移动方向无法确定
5.5 其他因素对理想气体反应平衡移动的影响随堂测验
1、一定T、p下,理想气体反应 SO2Cl2(g) ? SO2(g) + Cl2(g) 达到平衡。保持压力不变的情况下加入惰性气体,SO2Cl2(g)的转化率将( )。
A、增大
B、减小
C、不变
D、变化情况不能确定
第三章 热力学第二定律(一)
3.2.2 熵随堂测验
1、下列说法中正确的是( )。
A、系统经历可逆过程其熵值在不变;
B、系统处于平衡状态时的熵值最大;
C、隔离系统的熵值是守恒的;
D、如果系统发生一恒熵过程,则该过程必为绝热可逆过程。
3.2.4 熵增原理随堂测验
1、系统经历一个不可逆过程,其熵变ΔS一定大于0。
3.3.1 理想气体单纯pVT变化过程熵变计算随堂测验
1、绝热刚性系统中有一个刚性隔板,隔板左侧是101.325 kPa的空气,右侧抽成真空。现抽去隔板,空气充满整个系统,此过程的DS( )0。
A、>
B、=
C、<
D、≥
3.3.1 理想气体单纯pVT变化过程熵变计算随堂测验
1、某理想气体经历一节流膨胀过程,过程的DS( )0。
A、>
B、=
C、<
D、≥
第三章 热力学第二定律(二)
3.5.2 吉布斯函数随堂测验
1、一定量真实气体绝热可逆膨胀至终态,下列状态函数增量中,( )为零。
A、DU
B、DH
C、DS
D、DG
3.5.3 亥姆霍兹函数变及吉布斯函数变的计算随堂测验
1、在100℃、101.325 kPa的条件下,1 mol 液体水蒸发为水蒸气。则该过程中的DG ( ) 0。
A、>
B、<
C、=
D、≤
2、在100℃、101.325kPa的条件下,1 mol 液体水蒸发为水蒸气。则该过程中的DA ( ) 0。
A、>
B、<
C、=
D、≤
学习通物理化学_37
学习通物理化学_37是一门非常有挑战性的学科,对于学生而言,需要付出很多努力才能够掌握其中的知识。
学习重点
在学习通物理化学_37的过程中,需要重点掌握以下几个方面的知识:
- 化学反应速率
- 化学平衡
- 电解质溶液的电导
- 氧化还原反应
- 电化学
学习方法
在学习通物理化学_37的过程中,需要采用以下几种方法:
- 理论学习:通过课本、教师讲解等方式,理解各种化学概念及其实际应用。
- 实验学习:通过实验学习,深入了解化学各种变化过程,并加深对实际应用的理解。
- 交流互动:通过和同学互动交流,共同探讨学习中的难点、疑问,相互鼓励,提高学习效率。
学习建议
在学习通物理化学_37的过程中,需要遵循以下建议:
- 掌握基础知识:在学习学习通物理化学_37之前,需要先掌握一定的化学基础知识,如化学反应、化学平衡等。
- 善于思考:学习通物理化学_37需要善于思考,通过思考能加深对化学知识的理解。
- 多做题:学习通物理化学_37需要多做题,通过做题能够提高对化学知识的理解和运用能力。
- 掌握实验技能:学习通物理化学_37需要掌握实验技能,通过实验能够深入了解化学知识。
- 勇于挑战:学习通物理化学_37需要勇于挑战,尝试解决各种化学难题,提高自己的学习能力。
学习收获
学习通物理化学_37的过程中,不仅能够掌握化学的各种知识,还能够培养自己的实验能力、思考能力和解决问题的能力。这些能力不仅在学习中具有重要意义,也具有重要的实际应用价值。
因此,学习通物理化学_37不仅能够提高自己的学习成绩,也能够为自己的未来发展打下坚实的基础。